Una ecuación química es la representación simbólica de una reacción química o fenómeno químico.
En las reacciones químicas se pueden distinguir dos estados:
a) Un estado inicial, constituidos por las sustancias que intervienen en la reacción, denominadas reactivos.
b) Un estado final, representado por las sustancias que se producen en la reacción, llamadas productos.
El modo de representación de la reacción química que se puede emplear es a través de una ecuación química. En el primer miembro se escriben las fórmulas químicas de las sustancias que reaccionan y en el segundo, las representaciones de las que se forman.
El número total de átomos de cada elemento que hay en el primer miembro debe ser igual al número total que hay en el segundo.
Por ejemplo, los ácidos reaccionan con los hidróxidos con formación de agua y una sal. Estas reacciones son un caso de las denominadas reacciones de neutralización. Si las sustancias reaccionantes son ácido nítrico e hidróxido de calcio se forma nitrato de calcio y agua, y la reacción se representa mediante la ecuación química:
En ciertas ocasiones se agregan determinados símbolos para indicar otras características de la reacción o de las sustancias que intervienen en ella, tales como:
- Estado de agregación de las sustancias:: gas (g), líquido (l) y sólido (s).
- Formas de energía que intervienen en la reacción: calor (Ø), luz (hv)
- La formación de un precipitado (↓)
- El desprendimiento de un gas (↑)
Símbolos y números de oxidación de los elementos más comunes Aclaración: Esta es una tabla resumida de los elementos y sus números más comunes, el resto de elementos están en la tabla periódica de los elementos químicos.
- Electrones de valencia: Son los electrones que se encuentran en el último nivel de energía del átomo. Responsables de la interacción entre los átomos iguales o diferentes.
- El número de oxidación o estado de oxidación de electrones que un átomo involucra en la unión química. Es la valencia pero con signo. Para calcularlo se debe tener en cuenta las siguientes reglas:
- El número de oxidación de los átomos de los elementos en estado libre es cero. Los elementos pueden ser gases diatómicos, metales o moléculas poliatómicas. Ejemplo: H2, Fe, P4.
- Para los iones monoatómicos, el número de oxidación es igual a la carga del ion. Los metales alcalinos siempre tienen número de oxidación 1+, los alcalinos térreos 2+ y el aluminio 3+.
- El número de oxidación más común del hidrógeno cuando se encuentra combinado es 1+. Excepto cuando forma hidruros metálicos cuyo número de oxidación es 1-.
- El número de oxidación más común para el oxigeno es 2-, Las excepciones son los peróxidos cuyo número de oxidación es 1-.
- Los números de oxidación de los restantes elementos en una molécula poliatómica, se calculan considerando que la suma algebraica de los números de oxidación, multiplicados por los respectivos coeficientes de cada átomo en todo el compuesto molecular es igual a cero. Ejemplo: H2SO4.
Fórmulas químicasCompuestos químicos inorgánicos
Óxidos básicos: Se forman por la combinación del oxígeno con un elemento metálico. Su formula general es:

Donde 2 es el número de oxidación del oxígeno y n es el número de oxidación del metal.
Formulación:
La forma más simple es partir de sus elementos, simplemente con el número de oxidación con el que están actuando. Para el oxígeno es, en este tipo de compuestos, siempre 2-, mientras que para el otro elemento será positivo.
Veamos algunos ejemplo:
La suma de los números de oxidación de los átomos que forman el compuesto debe ser cero, la molécula es eléctricamente neutra. Ejemplo: Ni2O3
Reacción de obtención: (1) Empiezo por balancear el oxígeno. Multiplico el óxido por 2 y queda igualado el oxígeno, luego observo los átomos de metal que aparecen en el producto y simplemente coloco delante del metal el coeficiente estequeométrico que me permite balancear la reacción (2).
Ejemplo:
Nomenclatura
Existen distintas formas de nombrar los compuestos químicos:
- Nomenclatura por numeras de Stock (I.U.P.A.C): primero se indica el tipo de compuesto seguido del elemento principal, con su valencia entre paréntesis y el número romano. En caso de tener un sólo número de oxidación no es necesario poner la valencia en números romanos.
- Nomenclatura tradicional: Se indica primero el tipo de compuesto químico, y luego el elemento principal, usando diferentes terminaciones para hacer referencia al número de oxidación del elemento principal. Cuando el elemento posee un único número de oxidación, se nombra "Óxido de..."; cuando tiene dos números de oxidación, se usa la terminación "oso" para la menor, "ico" para la mayor.
.
Óxido ácidos: Se forman por la combinación del oxígeno con un elemento no metálico. Su formula general es:

Donde es el número de oxidación del oxígeno y n es el número de oxidación del no metal.
Formulación: Es igual a la de los óxidos básicos.
Reacción de obtención: Para obtener la ecuación de formación del óxido dse procede de la misma manera que en los óxidos básicos.
Nomenclatura
- Nomenclatura por numerales de stock (I.U.P.A.C): Es igual a la de los óxidos básicos. Veamos algunos ejemplos:
- Nomenclatura por atomicidad (I.U.P.A.C): Utiliza prefijos para cada elemento que indica la cantidad de veces que están presentes en ese compuesto. Ejemplo:
- Nomenclatura tradicional: Además de las formas ya mencionadas en óxidos básicos debemos agregar cuando ele elemento posee cuatro números de oxidación se utilizan prefijos además de las terminaciones "ico y "oso". Ejemplo:
Hidróxidos: Es la relación de un óxido básico con agua. Su formula general es:
Me es el catión y n es su valencia que indica el número de oxhidrilos necesarios para neutralizar la carga de ese catión. El subíndice del catión siempre es 1 ya que la carga del oxhidrilo es unitaria (1-).
Formulación: la manera más simple es partir desde el catión y el oxhidrilo. Ejemplo:
Nomenclatura: Podemos usar la nomenclatura tradicional, indicando el tipo de compuesto, y utilizando las terminaciones adecuadas según las mismas reglas que los "óxidos", o referirlo como "hidróxido de" seguido del nombre del catión. Ejemplos:
Reacción de obtención: Se realiza de la misma manera que para los óxidos, incluido el balanceo. Entre los reactivos están el óxido y el agua, y como producto el hidróxido.
En este caso, conviene comenzar el balanceo por el metal y luego balancear los oxígenos e hidrógenos.
Oxoácidos: Se forman por reacción de un óxido ácido con agua. Son compuestos de tipo temarios, que siempre tienen hidrógeno, oxígeno y otro elemento no metálico.
La formula general es:
E es el elemento no metálico.
Formulación: Se debe realizar teniendo en cuenta los números de oxidación de los elementos que forman la molécula y recordando que la suma de los números de oxidación debe ser cero.
Ejemplo: (A)
Nomenclatura: La I.U.P.A.C. admite el uso de la nomenclatura tradicional, anteponiendo la palabra ácido y agregando la terminación correspondiente (oso o ico) de acuerdo al número de oxidación del no metal.
En el ejemplo anterior (A) el nombre sería Acido Nitroso (corresponde a la menor valencia del nitrógeno).
En el caso que nos encontremos con una formula y tengamos que nombrarla hay que averiguar la valencia con la que actúa el elemento central, la forma más simple de hacerlo es sabiendo que:
- La carga total del compuesto es cero.
- El oxígeno, en este tipo de compuestos, actúa con número de oxidación 1+.
- El elemento central actúa como número de oxidación positivo
.Ejemplo:
Ahora podemos nombrarlo, ya que (6+) es el mayor número de oxidación del azufre, Acido Sulfúrico.
Casos especiales: a) Oxoácidos de P, As y Sb: estos tres elementos ubicados en el mismo grupo de la tabla periódica tienen el mismo comportamiento.
Todos forman óxidos con número de oxidación 3+ y 5+, cada uno de los cuales se puede combinar con una, dos y tres moléculas de agua, para dar oxoácidos, lo que suma un total de seis oxoácidos diferentes para cada elemento. Vemos el ejemplo del fosforo::
Para nombrarlos se siguen las siguientes reglas: cuando el óxido se combina con la mayor cantidad de moléculas de agua, es decir una, se antepone el prefijo "meta". Cuando el óxido se combina con la mayor cantidad de moléculas de agua, en este caso tres, se antepone "orto", y para el caso que se combine con dos moléculas de agua usamos el prefijo "piro".
Hidrácidos: Estos ácidos se forman por la combinación del hidrógeno, con números de oxidación 1+, y un elemento no metálico: flúor, cloro, bromo, yodo actuando con número de oxidación 1-, ó azufre actuando con número de oxidación 2-. Existen en forma acuosa.
Formulación: Escribimos primero el hidrógeno con la valencia del no metal como subíndice y luego el no metal, la formula general es:
Podemos formularlo conociendo el número de oxidación de cada elemento constituyente. Ejemplo:
Nomenclatura: Indica el tipo de compuesto, ácido, seguido del nombre del elemento terminado en "hídrico".
Sales: Se forman a partir de la combinación de un hidróxido con un ácido. Se hace perder al ácido sus H dejando los elementos restantes formando un anión, cuya carga será "igual al número de H perdidos"; por otro lado, hidróxido pierde sus oxhidrilos dejando al metal como catión. Estos dos iones interactúan entre si para formar la sal, mientras que los oxhidrilos y los protones, se combinan para dar agua. La carga del catión, que coincide con su número de oxidación, se coloca sin signo, como subíndice del anión y la carga del anión, sin signo, como subíndice del catión. esta reacción en partículas, se llama reacción de
neutralización y en ella siempre se produce una sal y agua. Ejemplo:
Para aprender a balancear estas reacciones: empieza por el elemento metálico, después equilibra el elemento principal del oxoácido y por último los H y O, en cualquier orden.
Nomenclatura: Para nombrar oxosales, según la I.U.P.A.C., se indica primero el nombre del anión, proveniente del ácido, utilizando el mismo tipo de nomenclatura, seguido del nombre del catión con su respectivo número de valencia, en romano y entre paréntesis. También se puede usarla nomenclatura tradicional para indicar la valencia del metal.
- Si el oxoácido termina en "oso" la sal termina en "ito".
- Si el oxoácido termina en "ico" la sal termina en "ato".
- Si el oxoácido termina en "hídrico" la sal termina en "uro".
Para el caso de NaClO --------> Hipoclorito de Sodio
Para el caso de LiCl --------> Cloruro de Litio
Sales ácidas y básicas: Algunas sales se forman por neutralización incompleta de los ácidos o las bases que las originan, cuando éstos poseen más de un hidrógeno u oxhidrilo respectivamente. En estos casos, la formula de la misma incluye uno o más hidrógenos si es una sal ácida, y uno o más oxhidrilos si es una sal básica.
Nomenclatura: Se indica, luego del nombre del anión, la presencia de hidrógeno u oxhidrilos con la palabra ácida o básica, respectivamente, e indicando su número usando los prefijos di, tri, etc.
Ejemplos:
Sulfato ácido de calcio ------> Ca(HSO4)2
Sulfato básico de calcio ------> [Ca(OH)]2 SO4
De los ejemplos anteriores podemos deducir que:
- Si la sal es ácida el/los hidrógeno/s siempre quedará/n unido/s al anión y formará/n parte de él.
- Si la sal es básica el/los oxhidrilo/s siempre quedará/n unido/s al elemento metálico y formará/n parte del catión.
Estructura de Lewis: En los enlaces químicos sólo entran en contacto los átomos a través de los electrones de las zonas exteriores o sea de la zona de valencia. Es por esa razón que al estudiarlos se consideran sobre todo los electrones de valencia.
Los símbolos de punto de Lewis representan el número de electrones de valencia que posee un átomo de un elemento dado y se utilizan, principalmente, para los elementos representativos.
Las estructuras de Lewis son útiles como modelos de enlace en muchos compuestos por lo cuál es muy importante practicar la escritura de las mismas, aunque no dan una visión completa del enlace covalente.
Carga formal: La diferencia entre los electrones de valencia de un átomo aislado y el número de electrones asignados a dicho átomo en una estructura de Lewis es la carga formal del átomo.
En una molécula, los electrones asociados con un átomo son: los pares libres del átomo + los electrones del par ó los pares de enlace entre el átomo de referencia y otro átomo o átomos.
Debido a que los electrones están compartidos en un enlace, se deben dividir equitativamente los electrones del par enlazante entre los átomos que forman el enlace.
Cuando se anotan las cargas formales, las siguientes reglas pueden ser útiles:
- Para moléculas neutras, la suma de las cargas formales debe ser cero.
- Para cationes, la suma de las cargas formales debe ser igual a la carga positiva.
- Para aniones, la suma de las cargas formales debe ser igual a la carga negativa.
Las cargas formales a menudo son útiles para elegir la estructura de Lewis más adecuada para un compuesto dado. Las reglas que se siguen son:
- Para moléculas neutras, se prefiere una estructura de Lewis para lo cual no haya cargas formales en lugar de aquellas que si la tienen.
- Las estructuras de Lewis con cargas formales grandes son menos probables que aquellas que tienen cargas formales más pequeñas.
- al elegir estructuras de Lewis que tengan distribuciones similares de la cargas formales, la estructura más probable es aquella en la cual las cargas formales negativas están colocadas en los átomos más electronegativos.
Escritura de estructura de Lewis de moléculas con un átomo central: Para definir estructuras de Lewis de compuestos inorgánicos con un átomo central y enlaces covalentes se deben seguir los siguientes pasos:
- Elaborar un boceto que muestre los átomos presentes en el enlace. Generalmente átomo menos electronegativo debe ocupar la posición central, el hidrógeno y el flúor se ubican en posiciones terminales de la estructura del Lewis.
- Contar el número de electrones de valencia presentes, en los aniones poliatómicos sumar el número total de cargas negativas y en los cationes poliatómicos restar el número de cargas positivas del total.
- Unir los átomos con una línea, el átomo central y cada uno de los átomos que lo rodean. completar el octeto de los átomos unidos al átomo central. Los electrones del átomo central y de los que lo rodean deben quedar como pares libres si no forman parte del enlace. El número de electrones empleados debe ser igual al calculado en el paso 2.
- Si no cumple la regla del octeto para el átomo central, agregue dobles o triples enlaces entre este átomo y los que lo rodean usando los pares libres de estos últimos.
Ejemplos:
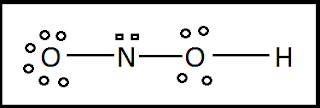
a) estructura de Lewis del ácido nitroso (HNO2)
Paso 1- La estructura básica del ácido es: O N O H
Paso 2- Número total de electrones: 1(H) + 5(N) + 6x2 (O)= 18 e- totales.
Paso 3- Dibujar un enlace sencillo entre el nitrógeno y los átomos de oxígeno, el hidrógeno queda en el extremo de la estructura. Llenar con los electrones necesarios para completar el octeto de los átomos de oxígeno.
Al finalizar este paso deben estar ubicados los electrones totales, o sea 18 e-.
Paso 4- Se observa que se cumple la regla del octeto para todos los átomos de oxígeno pero no para el átomo central. Por lo tanto se mueven electrones libres del oxígeno de los extremos para completar el octeto del átomo central.
Las cargas formales de los átomos se calculan de la siguiente manera:
- Átomo de N: Carga formal: 5 - 2 - 1/2(6) = 0
- Átomo de N=O: Carga formal: 6 - 4 - 1/2(4) = 0
- Átomo de N-O: Carga formal: 6 - 4 - 1/2(4) = 0.
b) Estructura de Lewis del anión metasilicato
(SiO3²-)Paso 1- Estructura básica del anión es:
O Si O
O
Paso 2- Número total de electrones: 4 (Si) + 6 x 3(O) + 2 = 24 e- totales.
Paso 3- Dibujar un enlace sencillo entre el silicio y los átomos de oxígeno. Llenar con los electrones necesarios para completar el octeto de los átomos de oxígeno:
Paso 4- Se observa que se cumple la regla del octeto en los átomos de oxígeno pero no en el átomo central. Por lo tanto se mueven electrones libres de los átomos de oxígeno de los extremos para completar el octeto del átomo central.
Las cargas formales de los átomos se calculan de la siguiente manera:
- Átomo de Si: Carga formal: 4- 0- 1/2(8) = 0
- Átomo de O en Si=O: Carga formal: 6 - 4 - 1/2(4) = 0
- Átomo de O en Si-O: Carga formal: 6 - 6 - 1/2 (2) = -1
Excepciones a la regla del octeto:
Octeto incompleto: En algunos compuestos el número de electrones que rodean al átomo central en una molécula estable es menor que ocho.
Ejemplo Be, cuya configuración es 2s², tiene dos electrones de valencia en el orbital 2s. La estructura del hidruro de berilio (BeH2) es:
H ---- Be ---- H
Hay sólo cuatro electrones que rodean al átomo de Be y no hay forma de satisfacer la regla del octeto.
Los elementos del grupo 3, en particular el B y el Al, también tienden a formar compuestos covalentes en los cuales el átomo central está rodeado por un número menor de ocho electrones. Para el B, su configuración es 1s² 2S² 2p¹ tiene tres electrones de valencia. Cuando se enlaza con los halógenos para dar compuestos cuya fórmula general es BX3, el B sólo tiene seis electrones alrededor. Ejemplo: trifluoruro de boro.